porque un atomo en equilibrio posee la misma cantidad de protones q electrones??
porque un atomo en equilibrio posee la misma cantidad de protones que electrones??
Supongamos que cualquier sustancia de la naturaleza la dividimos en partes cada vez más pequeñas, conservando cada una de ellas las propiedades de la sustancia inicial. Si seguimos dividiendo esta sustancia en fragmentos aún más pequeños, llegará un momento en que cada una de estas partes será indivisible, puesto que de efectuar una división más la porción dividida perderá las propiedades de dicha sustancia. Se habrá llegado, entonces, a dividir la sustancia en moléculas. La materia está compuesta por moléculas, siendo la molécula la parte más pequeña en la que se puede dividir una sustancia sin perder su naturaleza y propiedades. A su vez, una molécula está compuesta por átomos. Cada uno de ellos posee unas propiedades diferentes en el seno de la molécula que constituyen.
Sustancia o cuerpo simple es aquel cuya porción más pequeña en que puede dividirse, sin perder su naturaleza y propiedades, es un átomo. o Ejemplos: Cloro (Cl), Oxígeno (O), Carbono (C). • Sustancia o cuerpo compuesto es aquel cuya parte más pequeña en que puede dividirse sin perder sus propiedades es una molécula.
Ejemplo: Agua (H2O), cuya molécula incluye dos átomos de hidrógeno y uno de oxígeno
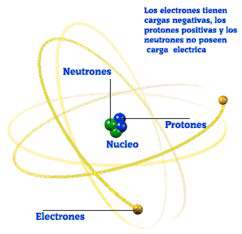
El átomo está constituido por un conjunto de partículas que proporcionan a cada elemento unas características que lo diferencian de todos los demás. De estas partículas, las tres más importantes son:
Protones (p+)
Tienen carga eléctrica positiva cuya magnitud es de aproximadamente 1,59 x 10-19 Culombios.
Su peso es de 1,67 x 10-27 kilogramos.
Electrones (e-)
Tienen carga eléctrica negativa de igual valor absoluto que la del protón, aunque de signo contrario.
Su peso es 1.840 veces inferior al del protón.
Neutrones (n.º)
Tienen carga eléctrica nula.
Su peso es aproximadamente igual al del protón.
Protones (p+)
Tienen carga eléctrica positiva cuya magnitud es de aproximadamente 1,59 x 10-19 Culombios.
Su peso es de 1,67 x 10-27 kilogramos.
Electrones (e-)
Tienen carga eléctrica negativa de igual valor absoluto que la del protón, aunque de signo contrario.
Su peso es 1.840 veces inferior al del protón.
Neutrones (n.º)
Tienen carga eléctrica nula.
Su peso es aproximadamente igual al del protón.
Primero Rutherford y más tarde Bohr idearon estructuras para intentar explicar el funcionamiento interno de los átomos. Estas estructuras se denominan modelos atómicos. Según Bohr, el átomo está dividido en dos zonas esenciales: núcleo y corteza.
• En el núcleo se encuentran los protones y los neutrones.
• Girando alrededor del núcleo, en órbitas o niveles de energía que constituyen la corteza, se hallan los electrones.
El tamaño del átomo es aproximadamente 10.000 veces mayor que el tamaño del núcleo. Casi la totalidad del peso de un átomo se encuentra en el núcleo, por lo que se puede considerar despreciable el peso total de la corteza frente al núcleo. • Peso atómico de un elemento es la suma del número de protones más el número de neutrones:
Por otra parte, un átomo en equilibrio es eléctricamente neutro. Ello significa (y aqui la respuesta) que el número de cargas positivas es igual al número de cargas negativas. En consecuencia, el número de protones coincide con el número de electrones.
A este número se le denomina número atómico:
Número atómico = N. de Protones = N. de Electrones
Peso atómico = Neutrones + Protones
Comentarios